Sisältö
- Hyvät ja huonot puolet
- Suositusten määrääminen
- Sivuvaikutukset
- Huumeiden vuorovaikutus
- Maksan vajaatoiminta
- Hepatiitti B: n uudelleenaktivoituminen
- Raskaudessa
Yhdysvaltain elintarvike- ja lääkevirasto hyväksyi Mavyretin 3. elokuuta 2017 käytettäväksi yli 18-vuotiaille. Tutkimukset viittaavat siihen, että lääke voi saavuttaa parantumisnopeuden välillä 92-100 prosenttia HCV-alatyypistä riippuen, mikä on enemmän tai vähemmän yhdenmukainen muiden tällä hetkellä hepatiitti C -hoidossa käytettävien suoraan vaikuttavien viruslääkkeiden (DAA) kanssa.
Hyvät ja huonot puolet
Mavyret pystyy hoitamaan kaikkia kuutta HCV-kantaa (genotyyppejä), ja sitä voidaan käyttää sekä henkilöillä, jotka eivät ole koskaan altistuneet HCV-lääkkeille, että niille, jotka ovat aiemmin epäonnistuneet hoidossa. Lisäksi lääkettä voidaan käyttää ihmisillä, joilla on kompensoitu kirroosi (jossa maksa on edelleen toimiva).
Mavyretillä on yksi keskeinen etu vastaaviin lääkkeisiin verrattuna, koska se voi hoitaa kroonista hepatiitti C -infektiota jopa kahdeksassa viikossa. Kaikki muut lääkkeet vaativat vähintään 12 viikkoa vasta hoidetuille potilaille. Tähän sisältyy yhdistelmä HCV-lääke Epclusa, joka on myös hyväksytty kaikille kuudelle genotyypille.
Toisin kuin Epclusa, Mavyretia ei kuitenkaan voida käyttää henkilöillä, joilla on dekompensoitu kirroosi (joiden maksa ei enää toimi).
Toinen keskeinen erottelija on hinta. Vaikka Epclusan kaltaisilla lääkkeillä on noin 75 000 dollarin tukkuhinta 12 viikon kurssille (tai 890 dollaria pilleriä kohti), Mavyretille tarjotaan 26 400 dollaria kahdeksan viikon kurssille (tai 439 dollaria tablettia kohden).
Hintaero voi olla riittävä vakuuttamaan sairausvakuutusyhtiöt laajentamaan hoitoa 3,9 miljoonaan amerikkalaiseen, jotka ovat kroonisesti saaneet HCV: n, joista useimpien on odotettava, kunnes on merkittävä maksan vajaatoiminta, ennen kuin hoito voidaan hyväksyä.
Suositusten määrääminen
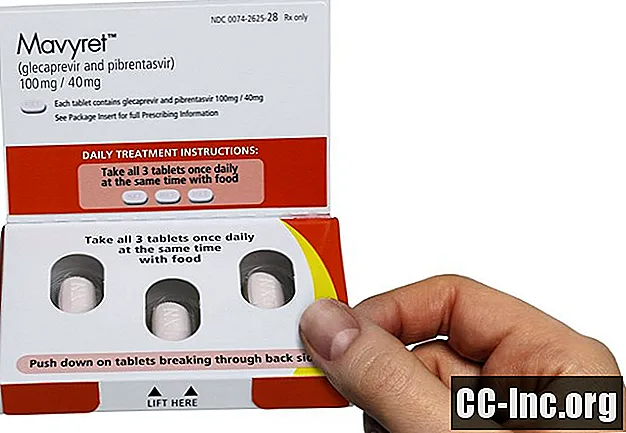
Suositeltu Mavyret-annos on kolme tablettia kerran päivässä ruoan kanssa. Yksi tabletti sisältää 100 milligrammaa glekapreviiria ja 40 milligrammaa pibrentasviiria. Tabletit ovat vaaleanpunaisia, pitkänomaisia, kalvopäällysteisiä ja niiden toiselle puolelle on painettu "NXT".
Hoidon kesto vaihtelee HCV-genotyypin, hoitokokemuksen ja potilaan maksatilan mukaan seuraavasti:
- Aiemmin hoitamaton ilman kirroosia: kahdeksan viikkoa
- Aiemmin hoitamaton kompensoitu kirroosi: 12 viikkoa
- Aiemmin hoidettu HCV-genotyypeillä 1, 2, 4, 5 ja 6 ilman kirroosia: kahdeksan - 16 viikkoa edellisestä hoidosta riippuen
- Aiemmin hoidettu HCV-genotyypeillä 1, 2, 4, 5 ja 6 kompensoidulla kirroosilla: 12-16 viikkoa edellisestä hoidosta riippuen
- Aiemmin hoidettu HCV-genotyypillä 3 kirroosilla tai ilman: 16 viikkoa
Noin 75 prosentilla amerikkalaisista, joilla on hepatiitti C, on genotyyppi 1, joka on yleisin mutta myös vaikein hoitaa. Sitä vastoin 20-25 prosentilla on genotyypit 2 ja 3, kun taas vain pienellä kouralla on genotyypit 4, 5 tai 6.
Sivuvaikutukset
Uudemman sukupolven DAA: lla, kuten Mavyretillä, on paljon vähemmän sivuvaikutuksia kuin aikaisemman sukupolven hoidoissa, joista moniin sisältyi lääkkeitä pegyloitu interferoni (peginterferoni) ja ribaviriini. Yleisimpiä Mavyretiin liittyviä haittavaikutuksia (esiintyy yli viidellä prosentilla potilaista) ovat:
- Päänsärky
- Väsymys
- Pahoinvointi
- Ripuli
Yleisesti ottaen sivuvaikutukset ovat hallittavissa ja parantuvat yleensä ajan myötä.Itse asiassa markkinointia edeltäneessä tutkimuksessa todettiin, että alle prosentti Mavyret-hoitoa saaneista ihmisistä lopetti hoidon sietämättömien sivuvaikutusten seurauksena.
Huumeiden vuorovaikutus
Tuberkuloosin hoitoon yleisesti käytettyjen rifampiinipohjaisten lääkkeiden käyttö on vasta-aiheista Mavyretin kanssa, ja se on lopetettava ennen hoidon aloittamista. Näihin kuuluvat lääkkeet, joiden tuotenimi on Mycobutin, Rifater, Rifamate, Rimactane, Rifadin ja Priftin.
Muiden lääkkeiden tiedetään olevan vuorovaikutuksessa Mavyretin kanssa, ja ne voivat joko lisätä tai vähentää Mavyretin pitoisuutta veressä. Seuraavia ei suositella käytettäväksi Mavyretin kanssa:
- Karbamepatsiini, jota käytetään kohtausten ja kaksisuuntaisen mielialahäiriön hoitoon
- Etinyyliestradiolia (estrogeenia) sisältävät ehkäisylääkkeet
- Sustiva (efavirentsi), jota käytetään HIV-hoidossa
- Atorvastatiini, lovastatiini ja simvastatiini, joita käytetään korkean kolesterolin hoitoon
- Mäkikuisma
Maksan vajaatoiminta
Mavyret on vasta-aiheinen potilaille, joilla on vaikea maksan vajaatoiminta (mitattuna Child-Pugh-arvolla C), eikä sitä suositella kenellekään, jolla on edes kohtalainen vajaatoiminta (Child-Pugh B).
Maksan toiminnan testaus on suositeltavaa ennen hoidon aloittamista komplikaatioiden välttämiseksi. Child-Pugh-pisteet ovat hyödyllisiä myös maksasairauden vakavuuden määrittämisessä verikokeiden ja tyypillisten oireiden tarkastelun perusteella.
Hepatiitti B: n uudelleenaktivoituminen
Mavyret-valmistetta tulee käyttää varoen henkilöillä, joilla on sekä hepatiitti B että hepatiitti C. Hepatiitti B -viruksen (HBV) tiedetään reagoivan hoidon aikana tai pian sen jälkeen. Uudelleenaktivoitumiseen voi liittyä keltaisuuden ja maksatulehduksen oireita. Jos hoitoa ei lopeta välittömästi, uudelleenaktivointi voi johtaa maksan vajaatoimintaan ja jopa kuolemaan.
Vaikka HBV-infektio ei ole vasta-aihe Mavyretin käytön kanssa, se edellyttäisi maksaentsyymien tarkempaa seurantaa reaktivaation varhaisen merkin tunnistamiseksi.
Raskaudessa
Vaikka Mavyret ei ole vasta-aiheinen raskauden aikana, todellisen riskin arvioimiseksi on saatavilla vain vähän kliinisiä tietoja ihmisistä. Tämän sanottuaan eläinkokeet ovat osoittaneet, että glekapreviirin ja pibrentasviirin käyttöön raskauden aikana ei liity sikiön poikkeavuuksia, mukaan lukien altistuminen imetyksen aikana.
Asiantuntijaneuvontaa suositellaan paitsi punnitsemaan hoidon hyödyt ja riskit, myös auttamaan määrittämään, onko hoito kiireellinen vai mikä voidaan viivästyttää synnytyksen jälkeen.
Raskauden ehkäisemiseksi hoidon aikana pariskunnille on suositeltavaa käyttää vähintään kahta ei-hormonaalista ehkäisymenetelmää hoidon aikana ja enintään kuusi kuukautta hoidon päättymisen jälkeen. Koska estrogeenipohjaista ehkäisyä ei suositella, keskustele lääkärisi kanssa, onko vain progestiinia sisältävä oraalinen ehkäisyvalmiste sopiva vaihtoehto.
- Jaa
- Voltti
- Sähköposti
- Teksti